
Révisions du brevet : Modéliser une transformation chimique.
L’essentiel :
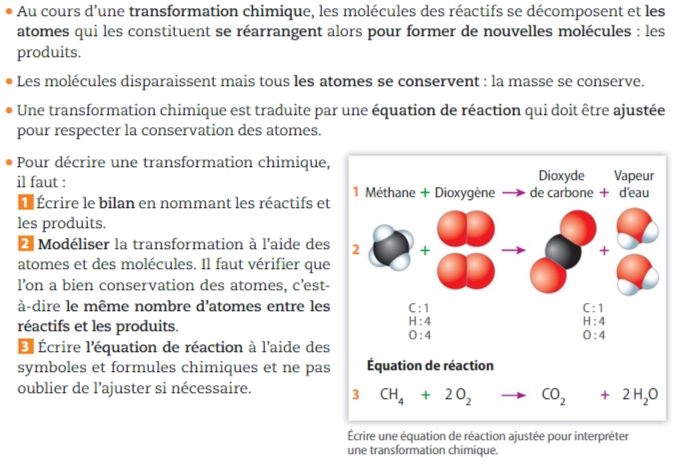
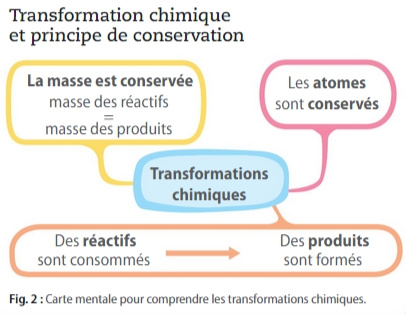
Une vidéo pour comprendre les transformations chimiques et leur modélisation : ICI
Des exercices pour s’entraîner :
Exercices 10, 11, 13, 14 et 19 pages 168 à 170 du livre.
Correction tout en bas :
Exercice 10 page 168 :
a-Le bilan de cette transformation chimique est :
butane + dioxygène ----------> dioxyde de carbone + eau
b-Au cours d’une transformation chimique les atomes se conservent en type et en nombre : nous devons retrouver autant d’atomes de chaque type du côté des réactifs et du côté des produits.
Faisons le décompte :
Carbone (C, sphère noire) : réactifs : 3 atomes dans une molécules de butane
produits : 3 atomes de carbone répartis dans les 4 molécules de dioxyde de carbone
Oxygène (O, sphère rouge) : réactifs : 10 atomes répartis dans les 5 molécules de dioxygène
produits : 10 atomes répartis en 6 atomes dans les 3 molécules de dioxyde de carbone et 4 atomes dans les 4 molécules d’eau.
Hydrogène (H, sphère blanche) : réactifs : 8 atomes dans une molécule de butane
produits : 8 atomes répartis dans 4 molécules d’eau.
Tous les atomes se conserbent en type et en nombre : cette modélisation est correcte !
c- d’après la modélisation nous avons l’équation de réaction :
C3H8 + 5 O2 ----------------> 3 CO2 + 4 H2O
(si le coefficient est 1, on ne le marque pas)
d-Par propotionnalité, pour 10 molécules de propoane consommées, 50 molécules de dioxygène réagiront (5 x 10).
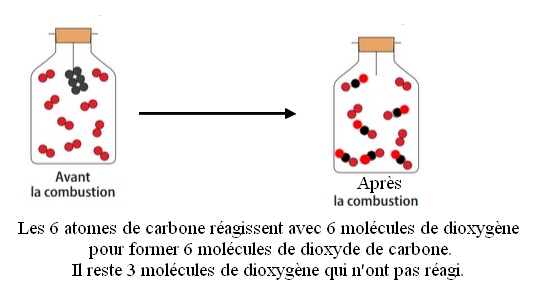
Exercice 11 page 168 :
Exercice 13 page 169 :
a-Les réactifs sont le dihydrogène : H2 et le dioxygène O2
b-Le produit formé est l’eau : H2O
c- Ce type de véhicule est qualifié de propre car il ne génère, lors de son fonctionnement, aucun déchet polluant mais seulement de l’eau.
(Attention, sa fabrication, sa commercialisation, son recyclage peuvent générer des déchets et une "pollution" !)
Exercice 14 page 169 :
a-Le réactif est le glucose (lire l’énoncé !), sa formule chimique est C6H12O6.
b-Les produits formés sont l’éthanol : C2H6O et le dioxyde de carbone CO2.
c-2 molécules d’éthanol sont obtenues à partir d’une molécule de glucose.
d-L’équation ajustée de réaction est :
C6H12O6 ---------------> 2 C2H6O + 2 CO2
Exercice 19 page 170 :
Pour résoudre cet exercice, il faut appliquer la loi de conservation des atomes au cours d’une transformation chimique : Nous devons retrouver autant d’atomes de chaque type de chaque côté :
acide éthanoïque + hexanol -----------------> arôme de poire + eau
C2H4O2 + C6H14O -------------> C8H16O2 + H2O
Attention à penser à compter la molécule d’eau formée !
- Podcast et RSS
- Plan
- Mentions
- Rédaction
- Se connecter

-
2009-2025 © Collège Hubert Fillay - Tous droits réservés
Ce site est géré sous SPIP 3.2.19 et utilise le squelette EVA-Web 4.2

Dernière mise à jour : vendredi 8 avril 2022