L’eau sur Terre et dans l’Univers.
Séance n°1 :

Une activité diagnostique (activité 1 en PJ) pour découvrir ou re-découvrir. Une petite partie de l’excellent dossier de la Main à la pâte à voir ICI

L’eau est présente sur Terre en très grande quantité. Elle peut se trouver sous trois états physiques différents : solide, liquide et gazeux. (Comme toute la matière dans l’Univers).
L’essentiel de l’eau liquide présente sur Terre est de l’eau salée (97%) se trouvant dans les océans. L’eau douce accessible à l’Homme ne représente qu’environ 0,1 % !

-Un exercice sur les états de la matière : ICI
-Un exercice pour distinguer l’eau dans différents états : ICI ou Là
-Un exercice sur la répartition de l’eau sur Terre : ICI
Séance n°2 :

TP n°1 : Une substance très "particulière" (TP1 en PJ).
Pour en savoir plus sur les liquides "non newtoniens" : ICI.

Les états de la matière se distinguent par des propriétés différentes.
Un solide peut être saisi entre les doigts, il possède une forme propre (bien à lui).
Un liquide peut couler et prend la forme du récipient qui le contient. Sa surface libre et plane et horizontale.
Un gaz prend la forme du récipient qui le contient et occupe tout l’espace disponible : il est expansible. On peut réduire l’espace qu’il occupe : il est compressible.

-Un exercice pour distinguer les états de la matière :ICI
-Un autre : là

Pour étudier la matière, les scientifiques peuvent mesurer son volume (V) et/ou sa masse (m).
Le volume (V) représente l’espace occupé par un objet dans l’espace. Le volume (V) peut se mesurer avec une éprouvette graduée.
La masse (m) représente la quantité de matière. Elle se mesure en kilogramme (kg) ou en gramme (g) avec une balance.

Un exercice sur la mesure de volume (V) :ICI
Ordres de grandeur et volume : ICI
Un autre : Exercice n°2 dans les fichiers joints à la fin de l’article.
Un exercice sur l’utilisation de la balance : Là
Ordres de grandeur et masse : ICI
Notions de masse et volume : ICI
Séance n°3 :

Un TP (TP n°2 en PJ) pour découvrir ou re-découvrir les conversions et les équivalences des unités de volume à l’occasion de petits "défis" expérimentaux.

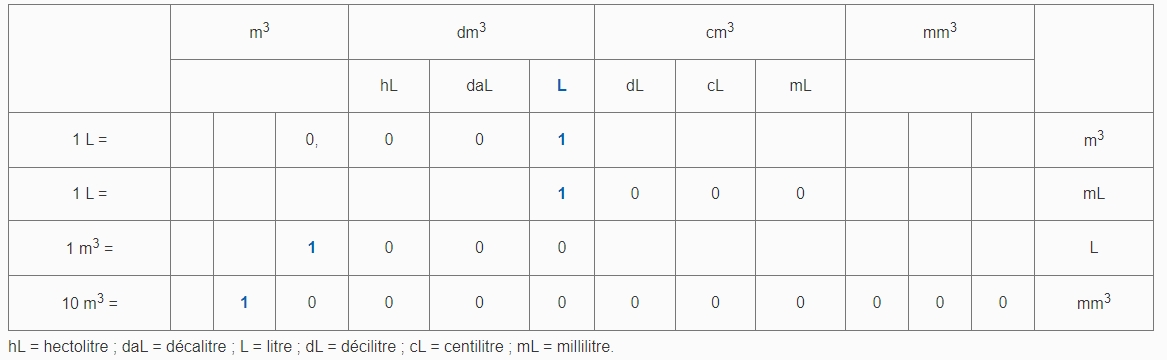
Il existe plusieurs unités de mesure du volume d’un objet.
Dans le système international (SI), il s’exprime en mètre cube (m³).
Les sous-multiples, par exemple le centimètre cube (cm³) sont couramment employés.
Dans la vie quotidienne, le litre (L) et ses sous-multiples, par exemple le millilitre (mL) sont également utilisés.
Ces unités sont reliées par des équivalences.
Pour déterminer le volume d’un solide, nous pouvons :
-Utiliser une formule mathématique si le solide à une forme géométrique ;
-Réaliser un déplacement d’eau.

Une leçon sur les notions de volume et de masse avec des exercices interactifs : ICI
Une animation sur la mesure de volume : Là
Notions de masse et de volume : ICI
Des conversions : ICI
Séance n°4 :

TP n°3 : De l’eau liquide à la vapeur d’eau.
TP en PJ. Pour réfléchir autour de la notion de vaporisation et apprendre à manipuler en toute sécurité.

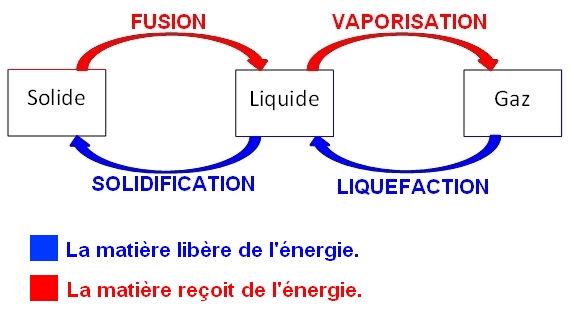
L’eau comme toute la matière peut changer d’état physique et passer d’un état à un autre.
Ce phénomène est une transformation physique réversible qui ne modifie en rien la nature de la matière : Sous forme de vapeur, liquide ou solide, l’eau reste de l’eau.
Au cours d’un changement d’état, de l’énergie thermique est transférée (reçue ou libérée par la matière).
La pression de la vapeur d’eau est utilisée dans les machines à vapeur. Celles-ci convertissent en partie l’énergie thermique en énergie mécanique.

Une animation pour montrer que la matière peut passer d’un état à un autre : ICI
Distinguer les changements d’état : Là et ICI
Séance n°5 :

TP n°4 : Etudions les changements d’état de l’eau pure. ExAO (TP n°4 à télécharger en fin d’article (prochainement))
Etude de la vaporisation et de la solidification de l’eau pure en ExAO.

Lorsqu’un corps pur change d’état, la curbe représentant l’évolution de la température (T) en fonction du temps (t) décrit un palier : la température reste constante au cours du changement d’état.
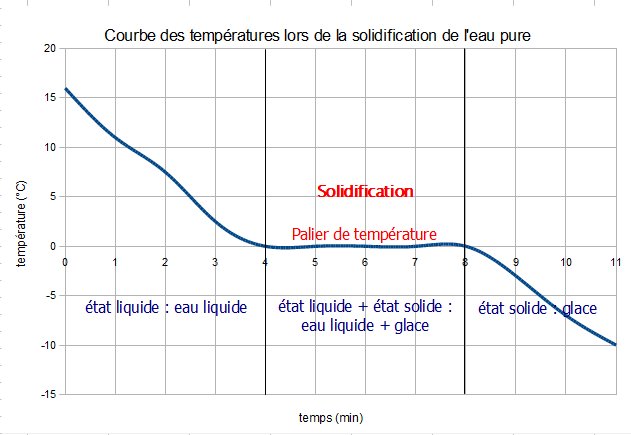
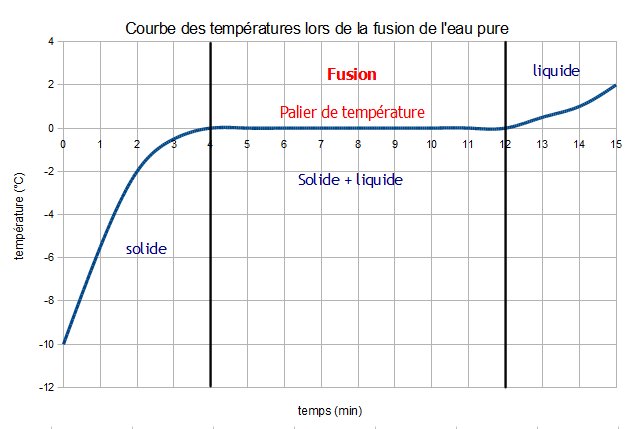
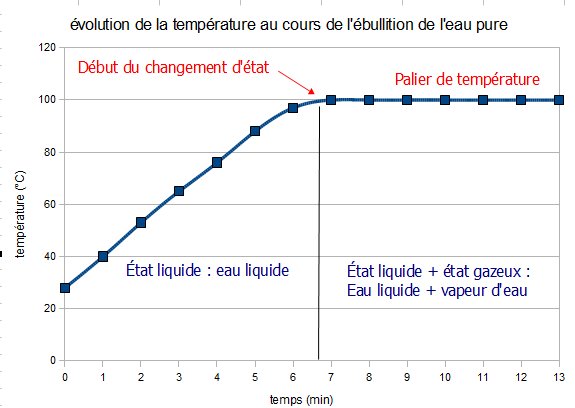
Des changements d’état inverses se produisent à la même température.
Ces températures de changement d’état sont différentes pour chaque corps pur et dépendent des conditions de pression atmosphérique.
Ainsi, pour l’eau pure à pression atmosphérique normale (1013 hPa) :
Tébullition=Tliquéfaction= 100 °C
Tsolidification= T fusion = 0°C

Une animation pour étudier la vaporisation par ébullition de l’eau pure : ICI
Une animation pour étudier la solidification de l’eau pure : ICI
Une animation pour étudier la fusion de l’eau pure : Là
Une animation pour étudier la solidification du cyclohexane : ICI
En cours de rédaction / Août 2017
Documents joints
 TP 1 : Une substance très particulière, PDF, 258.7 ko
TP 1 : Une substance très particulière, PDF, 258.7 ko
 Activité1, PDF, 203.7 ko
Activité1, PDF, 203.7 ko
 Exercice n°2 sur la masse (m) et le volume (V), HTML, 41.9 ko
Exercice n°2 sur la masse (m) et le volume (V), HTML, 41.9 ko
Mots croisés
 mesurer le volume d’un liquide avec une éprouvette graduée., HTML, 52.6 ko
mesurer le volume d’un liquide avec une éprouvette graduée., HTML, 52.6 ko
 TP n°2 : Différentes unités de volume. Des défis., PDF, 236.3 ko
TP n°2 : Différentes unités de volume. Des défis., PDF, 236.3 ko
 TP n°3 : De l’eau liquide à la vapeur d’eau., PDF, 2.8 Mo
TP n°3 : De l’eau liquide à la vapeur d’eau., PDF, 2.8 Mo
- Podcast et RSS
- Plan
- Mentions
- Rédaction
- Se connecter

-
2009-2025 © Collège Hubert Fillay - Tous droits réservés
Ce site est géré sous SPIP 3.2.19 et utilise le squelette EVA-Web 4.2

Dernière mise à jour : vendredi 8 avril 2022
